Vyjadrenie NIHO k stanovisku Healthy Future of Slovakia k liekovej politike
NIHO - Národný inštitút pre hodnotu a technológie v zdravotníctve reaguje na zavádzajúce tvrdenia uverejnené na stránkach Healthy Future of Slovakia.

Ľudsky síce rozumieme, že vzhľadom na prebiehajúcu kontrolu Najvyššieho kontrolného úradu SR na Ministerstve zdravotníctva SR, zameranú na špecifiká spôsobu zaraďovania nových liekov do kategorizácie po roku 2022, môžu niektoré osoby zodpovedné za vtedajšie rozhodnutia pociťovať nepokoj.
Rovnako rozumieme, že nepokoj v nich môže vzbudzovať aj pripravovaná Revízia výdavkov na lieky Ministerstva financií SR. Dohľadať sa dajú aj finančné a iné prepojenia viacerých expertov, ktorí ešte donedávna zastávali významné exekutívne funkcie, s farmaceutickým priemyslom.
Porozumenie vnútornej motivácii určitého konania však nemôže viesť k tolerancii voči šíreniu nezmyselných a zavádzajúcich tvrdení, početne zastúpených v Stanovisku Healthy Future Slovakia. V rámci tak potrebného boja proti dezinformáciám vo verejnom priestore považujeme za svoju povinnosť aspoň niektoré z nich vyvrátiť.
Séria mylných tvrdení Healthy Future of Slovakia
Po prvé
Tvrdenie: „Zákon platný od augusta 2022 nevyžaduje zásadné úpravy. Reforma umožnila prístup k chýbajúcim terapeutickým alternatívam, ktoré už dlhodobo predstavujú štandardnú liečbu v okolitých krajinách. Zverejnené výdavky na lieky zároveň jasne ukázali, že ide o najefektívnejšie riadenú položku v rámci celkových nákladov na zdravotníctvo, s klesajúcim podielom na rozpočte. To poukazuje na to, že problémom nie je legislatíva, ale schopnosť jej skutočného dodržiavania a implementácie liekovej politiky do praxe. A nielen pri nových liekoch.“
Fakty: Predovšetkým si dovoľujeme HFS upozorniť, že pojem „výdavky“ nie je synonymom pojmu „náklady“. Zatiaľ čo náklady vyjadrujú spotrebu zdrojov použitých na uspokojovanie konkrétnych zdravotných potrieb, výdavky predstavujú úbytok peňažných fondov na bankových účtoch alebo v hotovosti. Je preto nezmyslom poukazovať na „zverejnené výdavky“ v kontexte „celkových nákladov“.
Pokiaľ ide o výdavky na lieky, presné zhodnotenie efektivity ich riadenia po roku 2022 radi prenecháme Najvyššiemu kontrolnému úradu SR, ktorý v Stanovisku k návrhu štátneho rozpočtu na rok 2025 uvádza: „udržateľnosť výdavkov VZP nie je zabezpečená, a to vzhľadom na prudké zvýšenie výdavkov na lieky najmä v kategorizačnom zozname“.
Vo vzťahu ku kvalite novely zákona o rozsahu úhrad liekov z roku 2022 možno poukázať aspoň na niektoré z mnohých problémov, ktoré v praxi spôsobuje:
- spôsob, akým novela nastavila úhradu liekov na výnimky, je predmetom konania na Ústavnom súde SR – Verejný ochranca práv aj Správny súd Bratislava vo svojich podaniach precízne zdôvodňujú, prečo úpravu výnimiek považujú za protiústavnú a rozpornú so záväzkami SR vyplývajúcimi z medzinárodných dohovorov na ochranu ľudských práv,
- spôsob, akým novela nastavila obsah zmlúv o úhradách liekov (MEA zmlúv) dojednávaných medzi ministerstvom zdravotníctva a držiteľom registrácie lieku (farmaceutickou spoločnosťou) a proces ich uzatvárania, vrátane skúmania dopadov kategorizačných rozhodnutí na financovanie všetkých typov zdravotnej starostlivosti, je predmetom konania na Správnom súde Bratislava na základe správnej žaloby dvoch zdravotných poisťovní (s návrhom na začatie prejudiciálneho konania pred Súdnym dvorom EÚ pre rozpor právnej úpravy nastavenej novelou s právom EÚ a návrhom na podanie návrhu na Ústavný súd SR pre jej nesúlad s ústavou),
- zdravotné poisťovne – účastníci kategorizačného konania a platitelia zdravotnej starostlivosti sú úplne vylúčené z procesu uzatvárania dôverných MEA zmlúv a o podmienkach dohodnutých medzi ministerstvom a držiteľom registrácie sa dozvedia až pri vydaní rozhodnutia - člen kategorizačnej komisie za zdravotné poisťovne je podľa znenia zákona viazaný povinnosťou mlčanlivosti aj voči zdravotnej poisťovni, ktorú v komisii zastupuje,
- novelou zmätočne nastavený proces uzatvárania MEA zmlúv a absencia funkčného prepojenia na zákon o NIHO komplikujú postup v konaní a nútia jednotlivých aktérov strácať čas vyjasňovaním si svojich povinností a vzájomných vzťahov – napr. nie je nijako ukotvené, ako a kedy má NIHO reagovať na výhrady držiteľov registrácie k hodnoteniu, na riešenie týchto výhrad sa „spotrebúva“ čas určený na dojednanie MEA zmluvy a pod.
Problémom teda skutočne je novela z roku 2022. Ťažko totiž možno funkčne aplikovať nejasné, zmätočné a vzájomne rozporné ustanovenia, ktoré si každý aktér môže vyložiť presne tak, ako práve potrebuje. Na okraj dodávame, že ďalšie tvrdenia obsiahnuté v stanovisku o „dlhodobo extrémne reštriktívnych kritériách“ pre zaraďovanie liekov do systému sa javia byť v priamom rozpore s výrokmi expertov o optimálnom stave legislatívy. Kritériá zaraďovania a posudzovania liekov (kritériá kategorizácie a náležitosti farmako-ekonomického rozboru) sú dané legislatívou. HFS preto možno odporučiť, aby sa rozhodli – buď sú kritériá kategorizácie extrémne reštriktívne, náležitosti farmako-ekonomického rozboru nevhodné a dopady na rozpočet zle vyhodnocované alebo je legislatíva optimálna.
Po druhé
Tvrdenie: „Slovensko významne zaostáva za zvyškom EÚ a je zároveň extrémnym outlierom aj v rámci regiónu CEE. Kým priemerný čas dostupnosti v krajinách strednej a východnej Európy je približne 356 dní (CEE priemer, EFPIA WAIT 2024), slovenský priemer je až 797 dní – najhorší spolu s Poľskom. To znamená, že Slovensko samo výrazne ťahá regionálny priemer nadol. Dostupných je len 27 % nových liekov registrovaných EMA (vs. 46 % v EÚ, 40–50 % CEE, a 70–80 % vo vyspelých štátoch EÚ4/UK).“
{{suvisiace}}
Fakty: Indikátor WAIT hodnotí čas od registrácie lieku (povolenia jeho uvedenia na európsky trh) po jeho zaradenie do štandardných úhrad - v SR do kategorizácie. Kategorizačné konanie sa začína na základe žiadosti držiteľa registrácie o zaradenie lieku do kategorizácie. Je na držiteľovi, či túto žiadosť podá po roku, dvoch či piatich rokoch od povolenia lieku. Inak povedané – doba od povolenia lieku Európskou komisiou po podanie žiadosti o kategorizáciu je „na zodpovednosti“ držiteľa.
Vo všeobecnosti pritom rozhodne nie je možné tvrdiť, že držitelia podávajú žiadosti o kategorizáciu na Slovensku v krátkom čase po povolení lieku. Na ilustráciu možno poukázať na niekoľko liekov, ktoré v ostatnom období vzbudili verejnú pozornosť – a to aj na základe snáh o „formovanie“ verejnej mienky početnými mediálnymi výstupmi.
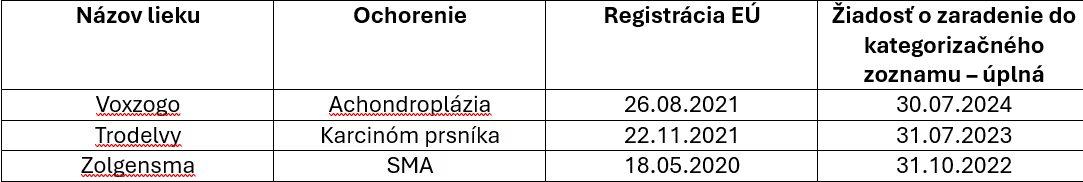
Po podaní žiadosti o kategorizáciu závisí priebeh konania aj od toho, ako rýchlo postupujú ministerstvo zdravotníctva a držiteľ registrácie pri vyjednávaní MEA zmluvy, či je potrebné žiadosť upraviť alebo doplniť, či držiteľ reaguje na hodnotenie NIHO a pod.
NIHO môže v procese ovplyvniť iba dodržanie lehoty na zverejnenie svojho hodnotenia. Tá je v zákone určená na 130 dní. Žiadnym spôsobom nepopierame, že v súčasnosti máme problém zákonnú lehotu dodržať. Nedodržanie lehoty na zverejnenie hodnotenia nie je spôsobené našim otáľaním pri realizácii jednotlivých úkonov. Je spôsobené výlučne nadštandardne veľkým množstvom hodnotení, ktoré je NIHO v súčasnosti povinné realizovať – čím rovnako netvrdíme, že tieto oneskorenia považujeme za prijateľné. Naopak, robíme všetko preto, aby odborné hodnotenia boli zverejnené čo najskôr.
Navyše, skutoční experti v liekovej politike dobre vedia, že o efektivite liekovej politiky nevypovedá samotné percento povolených liekov, ktoré sú hradené, ale reálny prínos hradených liekov. Ako zhrnuli Davis et al.: „takmer polovica liekov, ktoré úspešne ukončia II. etapu klinického skúšania, zlyhá v III. etape, väčšinou z dôvodu nedostatočnej bezpečnosti alebo účinnosti. To naznačuje, že ak sa nové lieky schvália na základe výsledkov II. etapy, existuje 50 % pravdepodobnosť, že sú nebezpečné, neúčinné alebo oboje“.
{{odporucane}}
Ako sumarizujú Falcone et al. v analýze liekov na solídne nádory povolené Európskou komisiou v rokoch 2015 až 2020, „mnoho liekov s rovnakým alebo podobným mechanizmom účinku bolo povolených na tú istú indikáciu bez vzájomného priameho porovnania. Okrem toho, väčšina týchto liekov vstúpila na trh bez dôkazu o celkovom prežívaní alebo kvalite života, iba na základe náhradných ukazovateľov“.
Brinkhuis et al. v analýze onkologických liekov povolených v EÚ v období rokov 1995 až 2020 zas dospeli k záveru, že „pri väčšine liekov sa investície do ich vývoja vrátili v priebehu niekoľkých rokov napriek tomu, že pacientom priniesli len malý dodatočný benefit. Osobitne to platí pre podmienene povolené lieky, pri ktorých v čase registrácie chýbali dôkazy o ich účinnosti“. Rovnako aj Wiesler et. al., vedúci zamestnanci nemeckého IQWiG -u, konštatujú, že viac ako polovica liekov, ktoré vstúpili v sledovanom období na nemecký trh, nepreukázala žiaden pridaný benefit. Na ilustráciu dopadov takýchto rozhodnutí na systém verejného zdravotného poistenia možno poukázať napr. na už deregistrovaný liek Translarna, pri ktorom EMA konštatovala nepreukázanú účinnosť v klinickej praxi, a ktorý iba v období od 1. januára 2022 do 30. júna 2024 stál slovenské zdravotné poisťovne viac ako 5,7 miliónov eur. Pre kontext možno uviesť, že z tejto sumy sa mohlo zaplatiť vyše 890 tisíc vyšetrení u špecialistu.
Po tretie
Tvrdenie: „Navrhovaná novelizácia zákona zavádza tzv. „zľavy na vstupe“ – mechanizmus, kde sa na základe slovenských HTA hodnotení budú výrazne znižovať dôverné ceny už pri prvom zaradení lieku. To znamená: 1. Prvé zaradenie: Slovenské HTA určí „fair price“ → výrobca musí poskytnúť vysokú zľavu, 2. Nové indikácie: Táto zľavnená cena sa stane východiskom pre ďalšie znižovanie → kumulatívny efekt 3. Regionálny dopad: Nízka slovenská cena sa cez ERP premietne do okolitých krajín“.
Fakty: Pozornosti HFS zrejme uniklo, že do externého referencovania (ERP) vstupuje úradne určená („oficiálna“) cena, a nie „cena“ (výška úhrady za jedno balenie lieku) dohodnutá v MEA zmluve ako dôverná. Dohodnutie zľavy na vstupe v MEA zmluve neznamená jej zverejnenie.
Všetky subjekty dodávateľského reťazca (veľkodistribútor, lekáreň, poskytovateľ zdravotnej starostlivosti, zdravotná poisťovňa) sú viazaní povinnosťou mlčanlivosti, ktorá je jednoznačne definovaná v právnych predpisoch vo vzťahu k MEA zmluvám – do týchto predpisov povinnosť mlčanlivosti vložila práve novela z roku 2022. Pre vysvetlenie (nielen) expertom: na základe mnohých MEA zmlúv dohodnutých po novele z roku 2022 musia zdravotné poisťovne hradiť farmaceutickým spoločnostiam plnú výšku úhrady za liek (podľa kategorizačného zoznamu) a až po skončení 12-mesačného obdobia trvania zmluvy im má byť vrátený rozdiel medzi výškou úhrady podľa MEA („zľavnenou cenou lieku“) a zaplatenou oficiálnou úhradou.
Takéto dojednania majú zásadne negatívny vplyv na zostavovanie rozpočtu verejnej správy – systém takýchto spätných platieb (ak sa ich vôbec podarí v plnosti „vymôcť“) vedie k prekračovaniu limitu výdavkov v neakceptovateľnom rozsahu, čím sa následne akékoľvek „rozpočtovanie“ (vrátane prípravy tzv. programovej vyhlášky) stáva de facto fiktívnou operáciou, so všetkými z toho plynúcimi dôsledkami na udržateľnosť systému. Zľava na vstupe naproti tomu znamená, že znížená úhrada dohodnutá v MEA sa uplatní už pri sprístupnení lieku – zdravotná poisťovňa teda neplatí „nič navyše“. V tejto súvislosti je vhodné vnímať, že elementárnou povinnosťou vyplývajúcou z čl. 40 Ústavy je zabezpečiť dostupnosť zdravotnej starostlivosti pre všetkých poistencov verejného zdravotného poistenia vo vzťahu ku všetkým typom hradenej zdravotnej starostlivosti. Vyhodnotenie dopadu tohto de facto bezúročného úverovania vybraných farmaceutických firiem z verejného zdravotného poistenia radi prenecháme Najvyššiemu kontrolnému úradu SR.
Po štvrté
Tvrdenie: „Navrhujeme, aby NIHO dodržiavalo všeobecne platné a moderné postupy HTA pri hodnotení liekov, a aby ich realizoval erudovaný tím s preukázateľným vzdelaním, zručnosťami a skúsenosťami, doloženými konkrétnymi projektmi a publikáciami“.
Fakty: NIHO od svojho vzniku pri hodnotení využíva všeobecne uznávanú európsku metodiku EUnetHTA. Pokiaľ ide o „preukázateľné vzdelanie“, je pravdou, že v tíme NIHO (na rozdiel od tímu HFS) nie je žiadna osoba so vzdelaním z vysokej školy v Bratislave, známej aj svojimi procesmi a kritériami na udeľovanie vedecko-pedagogických hodností (pozn. red. napríklad reportáž tu).
Máme však vo svojom tíme absolventov špičkových zahraničných univerzít so vzdelaním z rôznych odborov, vrátane farmácie, ekonomiky, a matematiky (viac ako 50 % zamestnancov NIHO má titul PhD.). Čo je však podstatnejšie - NIHO funguje viac ako tri roky, väčšina zamestnancov má teda viacročnú skúsenosť s on-hand praktickou prácou na HTA hodnoteniach, nielen teoretické akademické znalosti. NIHO je tiež súčasťou spoločného európskeho klinického hodnotenia (JCA). Aj zahraničné HTA agentúry využívajú ľudí s rôznorodým akademickým vzdelaním kvôli multidisciplinárnemu charakteru HTA.
Pokiaľ ide o ďalšie konkrétne odporúčania voči NIHO ohľadom zavedenia multikriteriálneho rozhodovania, štandardného využitia dát z reálnej terapeutickej praxe či úpravy lehôt, expertom by malo byť známe, že ide o faktory, ktoré sú dané legislatívou. Inak povedané, NIHO nemôže bez zmeny legislatívy z vlastnej iniciatívy posudzovať liek na základe iných než zákonom daných kritérií. Expertom preto možno odporučiť, aby sa oboznámili s platnou legislatívou (vrátane vykonávacích predpisov) a až následne formulovali svoje odporúčania pre jednotlivých aktérov.
Radi sa ale vyjadríme aj ku konkrétnym odporúčaniam expertov HFS:
- skrátenie lehoty na hodnotenie zo 130 na 90 dní - pri realizácii hodnotenia NIHO postupuje podľa ustálenej metodiky, v rámci ktorej sú jednotlivé na seba nadväzujúce úkony spojené s konkrétnou časovou dotáciou zodpovedajúcou ich reálnej náročnosti. Nie je preto možné niektorý z daných úkonov vynechať či urýchliť. Skrátenie tejto lehoty by možno viedlo k zrýchleniu konania, ale za cenu vyššej chybovosti a nižšej presnosti hodnotení,
- PSA analýza pri vysokej neistote (povinne pri orphanoch a ATMP) - pravdepodobnostná analýza citlivosti (PSA) je silný nástroj, ale nie je všeliek. Je potrebné poznať jej limitácie. Zatiaľ čo PSA vyhodnocuje neistotu vo vstupných dátach do farmako-ekonomického modelu, nevie vyhodnotiť kvalitu či validitu štúdie, z ktorej sú zberané dáta, či stavy v modeli sú zvolené adekvátne, akým spôsobom je modelované prežívanie (napr. použijeme exponenciálne rozdelenie alebo Gompertzovo, použijeme 2-uzlové splajny či trojuzlové splajny), akým spôsobom je modelovaná kvalita života (napr. pozeráme sa na utility v stavoch alebo ich vyhodnotíme podľa času do úmrtia). To, že má nová technológia vysokú neistotu, neznamená, že PSA bude užitočná. Najskôr je potrebné vedieť, z čoho pramení neistota a následne zvážiť, či by sa pomocou PSA dala lepšie vyhodnotiť. To platí pre všetky lieky bez ohľadu na orphan/ATMP status,
- použitie RWD (dát z reálnej praxe) - na zbieranie RWD na Slovensku by bolo vhodné mať funkčné registre, dopredu premyslený spôsob uceleného zberu dát a ich vyhodnocovania. Nie je nám zrejmé, čo experti myslia pod požiadavkou „jasnej metodickej väzby na § 88“. Veríme, že sú natoľko oboznámení so základnými princípmi a podstatou verejného zdravotného poistenia, že nemôžu reálne navrhovať, aby sa údaje o účinnosti a bezpečnosti lieku na účely kategorizácie systematicky zbierali v rámci výnimočných úhrad hradených z VZP.
NIHO víta diskusiu k budúcnosti liekovej politiky a je pripravené reflektovať každé odborné odporúčanie na zlepšenie svojej práce. V záujme úrovne a prínosu takejto diskusie by sme uvítali, aby osoby komunikujúce z pozície expertov nimi aj skutočne boli.
Celý obsah článku je prístupný pre predplatiteľov
Celý obsah článku je prístupný pre predplatiteľov
Momentálne nemáte aktívne žiadne predplatné.